中学三年の理科第1分野には「イオン」が登場します。イオンは電気分解や電池、酸・アルカリなどを理解する上で重要です。
目に見えないイオンと電子の動きを図で表して、「どうして電気分解が起こるのか?」をしっかり理解しましょう。
電気分解の実験装置を描く
まずは、実験装置の絵を描きましょう。今回は、白金(Pt)電極を用いて塩化銅水溶液を電気分解します。
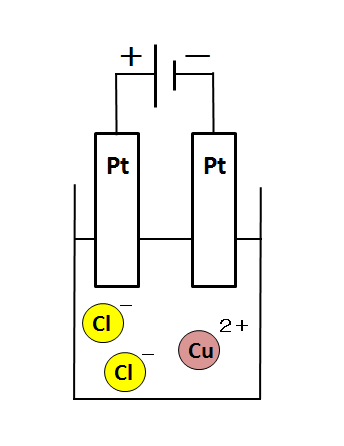
電源
装置の上の方に描かれている2本の縦棒は電源の記号です。
分かりやすいように+・-と書きました。何も書かれていなくとも、長い方が+極、短い方が-極です。
白金電極
Ptと書いてある2本の棒は電極です。
電気分解では電極自体が溶ける場合もあります。しかし、今回は、溶けない白金(Pt)電極を使っています。炭素棒(C)を電極にしても溶けません。
電源の+極とつながっている極を「陽極」、-極とつながっている極を「陰極」といいます。
塩化銅水溶液
ビーカーには塩化銅水溶液が入っています。綺麗な青色の液体です。
塩化銅は、水に溶かすと次のように分かれます。
電気を帯びていない固体の塩化銅が、水の中では正(+)の電気を帯びた銅イオン(陽イオン)と、負(-)の電気を帯びた塩化物イオン(陰イオン)に分かれます。この現象を「電離」といいます。
銅イオンや塩化物イオンの右上にある“2+”や“-”は覚えましょう。
イオンを理解する
イオンとは、原子や分子が電子を得たり失ったりして、電気を帯びた状態になることです。
電子は負(-)の電気を帯びています。電子を得た原子(分子)は、負(-)の電気を帯びた陰イオンになります。一方、電子を失った原子(分子)は、正(+)の電気を帯びた陽イオンになります。
電子の流れを理解する
イオンを考える上で避けて通れないのが電子の理解です。
電子は電流の正体です。電子は-極→+極の方向に流れます。電流の流れ(+極→-極)とは逆向きです。
電子は導線の中を動く
電子の流れを図に描き込みます。このとき、下の図のように考えてはいけません。
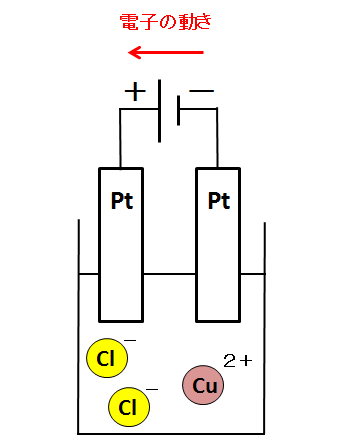
電気分解の問題では、導線上で電子の動きを考えます。上の図だと、電子が電池の中を動いているので間違いです。
電子の流れを正しく描いたのが下の図です。
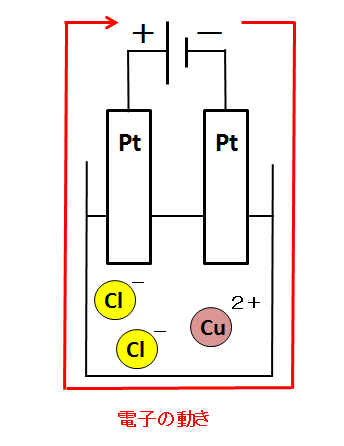
水溶液の中には導線がありません。導線がないところに電流は流れないのに、電気分解の実験では、塩化銅水溶液中を電流が流れます。この理由を考えましょう。
イオンの動きを理解する
塩化銅水溶液中にも電流が流れるのはイオンが動くからです。
イオンと電極の関係
イオンは電気を帯びているため、電源とつながっている電極にひきつけられます。
- 陽(+)イオン → 陰極(-)にひきつけられる
- 陰(-)イオン → 陽極(+)にひきつけられる
「陽(+)」と「陰(-)」がセットです。男女のカップルをイメージすると分かりやすいでしょう。
したがって、塩化銅水溶液中の銅イオン(+)は陰極(-)で反応して、塩化物イオン(-)陽極(+)で反応します。陰極からは金属の銅が析出して、陽極からは気体の塩素が発生します。
電子のやり取り
銅イオンは+なので、電子(-)を欲しがります。そのため、電源から流れてくる電子を陰極から受け取ります(以下の式のe–は電子です)。
一方、塩化物イオンは-なので、余分な電子(-)を捨てたがります。そのため、自分にくっついている電子を陽極に手放します。
これらの式を図に書き込むと下のようになります。
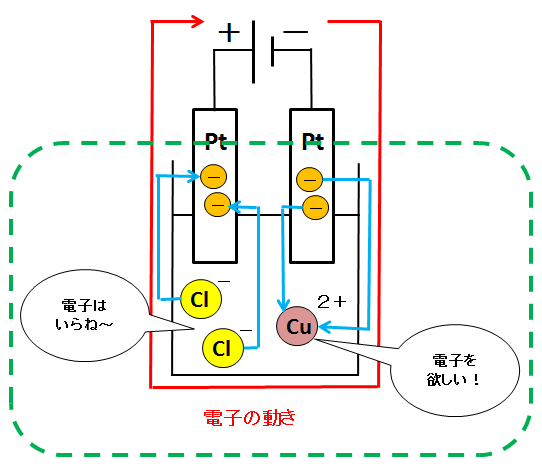
緑色の点線で囲われた部分から、導線が無い水溶液中で、イオンが電極と電子をやり取りしているのが分かるでしょう。このことが、電気分解で塩化銅水溶液中を電流が流れる理由です。
丸暗記ではなく理屈を理解する
電気分解を理解する上で、電子の動きを図にすることがとても大切です。
電気分解の問題は、定期試験だけでなく、高校入試でもよく出ます。用語やイオン式を丸暗記するのであなく、図を描きながら理屈を理解する勉強を大切にしましょう。
トップ画像=Pixabay



コメント
図でわかりやすかったです!
ちなみに、花丸がもらえるレポートの書き方はありますか?
コメントありがとうございます!
お役に立てたようで、僕も嬉しいです。
レポートの形式的な書き方は、理科の教科書を参考にした方がいいでしょう。
ただ、花丸を狙うのでしたら、以下のページを参考にしてください。
https://mimizuku-edu.com/tutor/homework/1374
こちらは酸化・還元がテーマですが、どの実験でも書き方は同じです。
がんばってください!